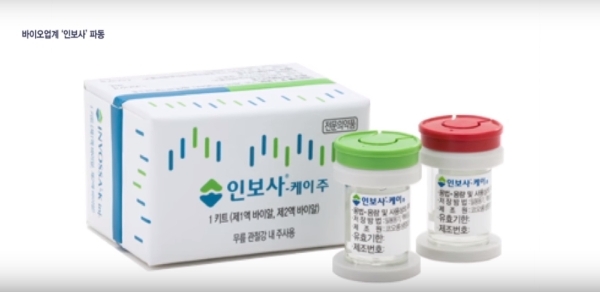
13일 코오롱생명과학은 지난 11일 코오롱티슈진이 FDA로부터 임상보류 해제(Remove Clinical Hold) 공문을 받았다고 밝혔다. 인보사에 대한 모든 임상보류 요소들이 해결됐으며, 인보사의 임상시험을 재개해도 좋다는 내용이다.
이에 식약처는 지난해 5월 말 인보사의 품목허가를 취소하겠다고 밝힌 이후 이의 신청 등을 거쳐 결국 7월 9일 자로 품목허가를 취소하고 국내 허가권자인 코오롱생명과학을 형사고발했다.
한편 FDA는 작년 9월에도 코오롱티슈진이 1차로 제출한 자료를 검토 후 임상승인 관련 추가 보완 자료를 요구해 코오롱티슈진이 자료를 제출한 바 있다. FDA가 자료를 보완하라고 요구한 것은 향후 임상3상을 재개할 여지를 남긴 것으로 풀이된다.
이번 FDA 결정이 인보사의 효능과 안전성을 완전히 인정한 것은 아닌 것으로 전해졌다. 다만 FDA가 인보사의 생산 공정에 대한 개선안과 시료의 안정성에 대해 데이터를 요구한 만큼 코오롱티슈진이 인보사의 효능과 안전성을 입증할 기회를 재차 얻었다는 분석이다.
코오롱티슈진 측은 “현재까지의 임상시험 데이터가 유효하며 이에 기초해 기존의 2액세포로 미국 임상3상 시험을 계속 진행할 수 있다고 FDA가 인정해준 의미”라고 설명했다.
이어 “코오롱티슈진은 FDA와의 협의에 따라 아래 사항에 대하여 미국 임상시험 환자 동의서류와 임상시험계획서를 30일 이내에 제출할 예정”이라며 “관련 후속 절차를 거친 후에 미국 임상시험환자 투약을 재개할 계획”이라고 말했다.
[관련기사]
가장 핫한 경제 소식! 한국금융신문의 ‘추천뉴스’를 받아보세요~
데일리 금융경제뉴스 Copyright ⓒ 한국금융신문 & FNTIMES.com
저작권법에 의거 상업적 목적의 무단 전재, 복사, 배포 금지











![IB '신흥강자' 키움증권, 김영국·구성민 전면 배치 [빅10 증권사 IB 人사이드 ④]](https://cfnimage.commutil.kr/phpwas/restmb_setimgmake.php?pp=006&w=284&h=214&m=5&simg=2026020100281000034dd55077bc211821821443.jpg&nmt=18)
![강진두號 KB증권 IB 출범…주태영·안석철 배치 '2.0' 개막 [빅10 증권사 IB 人사이드 ③]](https://cfnimage.commutil.kr/phpwas/restmb_setimgmake.php?pp=006&w=284&h=214&m=5&simg=2026012509581004894dd55077bc25812315153.jpg&nmt=18)
![한투증권 IB그룹장 재건…‘전략통' 김광옥 부사장 복귀 [빅10 증권사 IB 人사이드 (2)]](https://cfnimage.commutil.kr/phpwas/restmb_setimgmake.php?pp=006&w=284&h=214&m=5&simg=2026011801440707653dd55077bc25812315214.jpg&nmt=18)
![미래에셋증권 IB사령탑 강성범…양날개는 성주완·김정수 [빅10 증권사 IB 人사이드 ①]](https://cfnimage.commutil.kr/phpwas/restmb_setimgmake.php?pp=006&w=284&h=214&m=5&simg=2026011117585504903dd55077bc2118218214112.jpg&nmt=18)
![빗썸, IPO 추진 동력 지속…체질 개선 총력 [가상자산 거래소 지각변동 ④]](https://cfnimage.commutil.kr/phpwas/restmb_setimgmake.php?pp=006&w=284&h=214&m=5&simg=2026020100324904384dd55077bc211821821443.jpg&nmt=18)


![강성묵號 하나증권, 증시 호조 등 영업익 증가…"수수료·운용수익 증대" [금융사 2025 실적]](https://cfnimage.commutil.kr/phpwas/restmb_setimgmake.php?pp=006&w=284&h=214&m=5&simg=2025111214493308930179ad43907222110701.jpg&nmt=18)
![기관 '한미반도체'·외인 'NAVER'·개인 '삼성전자' 1위 [주간 코스피 순매수- 2026년 1월26일~1월30일]](https://cfnimage.commutil.kr/phpwas/restmb_setimgmake.php?pp=006&w=110&h=79&m=5&simg=2026013022473402636179ad439071182357237.jpg&nmt=18)
![기관 '에코프로'·외인 '에코프로'·개인 '알지노믹스' 1위 [주간 코스닥 순매수- 2026년 1월26일~1월30일]](https://cfnimage.commutil.kr/phpwas/restmb_setimgmake.php?pp=006&w=110&h=79&m=5&simg=2026013022563407542179ad439071182357237.jpg&nmt=18)

![다올투자증권, 연간 흑자 달성 성공…황준호 대표 실적 안정화 견인 [금융사 2025 실적]](https://cfnimage.commutil.kr/phpwas/restmb_setimgmake.php?pp=006&w=110&h=79&m=5&simg=2025081416515608997179ad439072111812010.jpg&nmt=18)
![NH투자증권, 순이익 '1조 클럽' 기록…윤병운 대표 "전 사업부문 경쟁력 강화" [금융사 2025 실적]](https://cfnimage.commutil.kr/phpwas/restmb_setimgmake.php?pp=006&w=110&h=79&m=5&simg=2025021021370308671179ad439072211389183.jpg&nmt=18)